گاز نیتروژن
نیتروژن (N) ، عنصر غیر فلزی گروه 15 [Va] از جدول تناوبی. این گاز بی رنگ ، بی بو و بی مزه است که فراوان ترین عنصر جو زمین است و ماده تشکیل دهنده تمام موجودات زنده است.
تاریخچه
حدود چهار پنجم جو زمین ازت است ، که در تحقیقات اولیه هوا جدا شده و به عنوان یک ماده خاص شناخته شد. کارل ویلهلم شل ، شیمیدان سوئدی ، در سال 1772 نشان داد که هوا مخلوطی از دو گاز است که یکی از آنها را “هوای آتش” می نامد ، زیرا این امر از احتراق پشتیبانی می کند ، و دیگری “هوای ناپاک” ، زیرا پس از آن باقی مانده بود. هوای آتش “استفاده شده بود البته “هوای آتش” اکسیژن و نیتروژن “هوا ناپاک” بود. تقریباً در همین زمان ، نیتروژن توسط یک گیاه شناس اسکاتلندی ، دانیل رادرفورد (که اولین کسی بود که یافته های خود را منتشر کرد) ، توسط شیمیدان انگلیسی ، هنری کاوندیش ، و روحانی و دانشمند انگلیسی ، جوزف پریستلی ، که به همراه شل ، به رسمیت شناخته شد. اعتبار برای کشف اکسیژن داده می شود. کار بعدی نشان داد که گاز جدید به عنوان ماده تشکیل دهنده نیترات ، نام مشترک نیترات پتاسیم (KNO3) است و بر این اساس ، آن را شیمی درمانی فرانسوی ژان آنتوان آن کلود شپتال در سال 1790 از نیتروژن نامید. نیتروژن برای اولین بار یک ماده شیمیایی در نظر گرفته شد. عنصری از آنتوان لوران لاوویزایر ، که توضیح نقش اکسیژن در احتراق سرانجام نظریه فلوگوستون را برانداز کرد ، یک دیدگاه نادرست از احتراق که در اوایل قرن 18th رایج شد. ناتوانی نیتروژن در حمایت از زندگی (یونانی: zoe) باعث شد لاوویزایر آن را از آزوت ، که هنوز معادل فرانسه نیتروژن است ، نام ببرد.
رویداد و توزیع
از بین عناصر ، نیتروژن در وفور کیهانی در رتبه ششم قرار دارد. جو زمین از 75.51 درصد وزن (یا 78.09 درصد از نظر حجم) ازت تشکیل شده است. این منبع اصلی نیتروژن برای تجارت و صنعت است. جو حاوی مقادیر کمی متفاوت نمک آمونیاک و آمونیوم و همچنین اکسیدهای ازت و اسید نیتریک است (مواد دوم که در طوفان های الکتریکی و در موتور احتراق داخلی تشکیل می شوند). نیتروژن آزاد در بسیاری از شهاب سنگ ها یافت می شود. در گازهای آتشفشان ، معادن و برخی از چشمه های معدنی. در خورشید؛ و در بعضی از ستاره ها و سحابی ها
نیتروژن همچنین در ذخایر معدنی نیترات یا نمکدان (نیترات پتاسیم ، KNO3) و نمک شیلی (نیترات سدیم ، NaNO3) رخ می دهد ، اما این ذخایر در مقادیری وجود دارد که برای نیازهای انسان کاملاً ناکافی است. ماده دیگری که سرشار از نیتروژن است گانو است که در غارهای خفاش و در مکانهای خشک که پرندگان از آن استفاده می شود یافت می شود. در ترکیب ، نیتروژن در باران و خاک به عنوان نمک های آمونیاک و آمونیوم و در آب های دریا به عنوان آمونیوم (NH4 +) ، نیترات (NO2-) و نیترات (NO3-) یون یافت می شود. ازت به طور متوسط حدود 16 درصد از وزن ترکیبات آلی پیچیده معروف به پروتئین را تشکیل می دهد که در تمام موجودات زنده وجود دارد. فراوانی طبیعی نیتروژن در پوسته زمین 0.3 قسمت در هر 1000 است. فراوانی کیهانی – تخمین فراوانی کل در جهان – بین سه تا هفت اتم در اتم سیلیکون است ، که به عنوان استاندارد در نظر گرفته شده است.
هند ، روسیه ، ایالات متحده ، ترینیداد و توباگو و اوکراین پنج تولید کننده برتر نیتروژن (به شکل آمونیاک) در اوایل قرن بیست و یکم بودند.
تولید و استفاده تجاری
تولید تجاری ازت عمدتاً با تقطیر کسری هوا مایع صورت می گیرد. دمای جوش نیتروژن 95195.8 درجه سانتیگراد (-320.4 درجه فارنهایت) ، حدود 13 درجه سانتیگراد (-23 درجه فارنهایت) کمتر از اکسیژن است ، که به همین دلیل کنار گذاشته می شود. نیتروژن همچنین با سوزاندن کربن یا هیدروکربن ها در هوا و جدا کردن دی اکسید کربن و آب حاصل از نیتروژن باقیمانده می تواند در مقیاس بزرگ تولید شود. در مقیاس کوچک ، نیتروژن خالص با گرم کردن آزید باریم ، Ba (N3) 2 ساخته می شود. واکنشهای آزمایشگاهی مختلفی که ازت حاصل از نیتروژن را در بر می گیرند شامل محلول های گرم کردن نیترات آمونیوم (NH4NO2) ، اکسیداسیون آمونیاک توسط آب برم و اکسیداسیون آمونیاک توسط اکسید گرم فوم است.
ازت می تواند به عنوان یک فضای بی اثر برای واکنش هایی که نیاز به خروج اکسیژن و رطوبت دارند استفاده شود. در حالت مایع ، نیتروژن کاربردهای ارزنده ای دارد. به غیر از گازهای هیدروژن ، متان ، مونوکسید کربن ، فلوئور و اکسیژن ، تقریبا همه مواد شیمیایی دارای فشار بخار ناچیز در نقطه جوش ازت هستند و بنابراین به عنوان جامدهای کریستالی در آن دما وجود دارند.
در صنایع شیمیایی از نیتروژن بعنوان ماده جلوگیری کننده از اکسیداسیون یا خراب شدن دیگر محصول به عنوان یک ماده رقیق کننده بی اثر یک گاز واکنش دهنده ، به عنوان حامل حذف گرما یا مواد شیمیایی و به عنوان مهار کننده آتش یا انفجار استفاده می شود. در صنایع غذایی از گاز نیتروژن برای جلوگیری از هدر رفتن از طریق اکسیداسیون ، قالب یا حشرات استفاده می شود و ازت مایع برای خشک کردن یخ و سیستم های تبرید استفاده می شود. در صنعت برق از نیتروژن برای جلوگیری از اکسیداسیون و سایر واکنشهای شیمیایی ، برای تحت فشار قرار دادن کت های کابل و محافظت از موتورها استفاده می شود. نیتروژن در صنایع فلزات در جوشکاری ، لحیم کاری و تراشکاری ، جایی که به جلوگیری از اکسیداسیون ، کاربراسیون و دفع زدایی کمک می کند ، کاربرد دارد. به عنوان یک گاز غیر واکنشی ، ازت برای ساختن لاستیک ، پلاستیک و الاستومرها به عنوان یک پیشرانه سوخت استفاده می شود تا به عنوان یک گاز احتراق برای قوطی های آئروسل و برای فشار آوردن به سوخت های مایع برای جت های واکنش استفاده شود. در پزشکی ممکن است از انجماد سریع با نیتروژن مایع برای حفظ خون ، مغز استخوان ، بافت ، باکتری و مایع منی استفاده شود. ازت مایع نیز در تحقیقات کرایوژنیک مفید است.
ترکیبات
گرچه کاربردهای دیگر مهم هستند ، اما بیشترین بخش ازت در ساخت ترکیبات ازت مصرف می شود. پیوند سه گانه بین اتم ها در مولکول های نیتروژن به قدری قوی است (226 کیلو کالری در هر مول ، بیش از دو برابر هیدروژن مولکولی) که ورود به آن دشوار است.
روش اصلی تجاری برای اصلاح نیتروژن (ترکیب نیتروژن عناصر در ترکیبات) فرایند هابر-بوش برای سنتز آمونیاک است. این روند در طول جنگ جهانی اول توسعه داده شد تا وابستگی آلمان به نیترات شیلی کمتر شود. این شامل سنتز مستقیم آمونیاک از عناصر آن است.
مقادیر زیادی ازت به همراه هیدروژن برای تولید آمونیاک ، NH3 ، یک گاز بی رنگ با بوی تند و تحریک کننده استفاده می شود. روش اصلی تجارت سنتز آمونیاک فرآیند هابر-بوش است. آمونیاک یکی از دو ترکیب اصلی نیتروژن تجارت است. این ماده در ساخت سایر ترکیبات مهم نیتروژن کاربردهای زیادی دارد. بخش عمده ای از آمونیاک سنتز تجاری به اسید نیتریک (HNO3) و نیترات ها تبدیل می شود که نمک و استرهای اسید نیتریک هستند. آمونیاک در فرآیند سودا آمونیاک (فرآیند Solvay) برای تولید خاکستر سودا ، Na2CO3 استفاده می شود. آمونیاک همچنین در تهیه هیدرازین ، N2H4 ، یک مایع بی رنگ به عنوان سوخت موشک و در بسیاری از فرآیندهای صنعتی مورد استفاده قرار می گیرد.
اسید نیتریک یکی دیگر از ترکیبات تجاری محبوب نیتروژن است. یک مایع بی رنگ ، بسیار خورنده ، بسیار مورد استفاده در تولید کود ، رنگ ، مواد مخدر و مواد منفجره است. اوره (CH4N2O) شایع ترین منبع ازت در کودها است. نیترات آمونیوم (NH4NO3) ، نمکی از آمونیاک و اسید نیتریک نیز به عنوان یک جزء نیتروژن کودهای مصنوعی مورد استفاده قرار می گیرد و همراه با روغن سوخت به عنوان ماده منفجره (ANFO) استفاده می شود.
با داشتن اکسیژن ، نیتروژن چندین اکسید از جمله اکسید نیتروژن ، N2O تشکیل می دهد که در آن نیتروژن در حالت اکسیداسیون 1+ قرار دارد. اکسید نیتریک ، NO ، که در آن در حالت +2 قرار دارد. و دی اکسید نیتروژن ، NO2 ، که در آن در حالت +4 است. بسیاری از اکسیدهای نیتروژن بسیار بی ثبات هستند. آنها منابع اصلی آلودگی جو هستند. اکسید نیتروژن ، همچنین به عنوان گاز خنده شناخته می شود ، گاهی اوقات به عنوان بی حس کننده استفاده می شود. هنگام استنشاق ، هیستری خفیف ایجاد می کند. اکسید نیتریک به سرعت با اکسیژن واکنش نشان می دهد تا دی اکسید نیتروژن قهوه ای تشکیل شود ، واسطه ای در تولید اسید نیتریک و یک ماده اکسید کننده قدرتمند است که در فرآیندهای شیمیایی و سوخت های موشکی مورد استفاده قرار می گیرد.
از نظر برخی نیتریدها ، مواد جامد که با ترکیب مستقیم فلزات با نیتروژن ، معمولاً در دماهای بالا تشکیل می شوند ، از اهمیت خاصی برخوردار هستند. این مواد شامل مواد سخت کننده تولید شده در هنگام گرم شدن فولادهای آلیاژی در اتمسفر ، فرایندی به نام نیتراسیون است. آنهایی که از بور ، تیتانیوم ، زیرکونیوم و تانتالوم کاربردهای ویژه ای دارند. به عنوان مثال ، یک شکل کریستالی نیترید بور (BN) تقریباً به اندازه الماس سخت است و به راحتی اکسید می شود و به عنوان یک ساینده در دمای بالا مفید است.
سیانیدهای معدنی حاوی گروه CN− هستند. هیدروژن سیانید یا فرمیونتریل ، HCN ، یک گاز بسیار فرار و بسیار سمی است که در بخار ، غلظت سنگ و سایر فرآیندهای صنعتی دیگر مورد استفاده قرار می گیرد. سیانوژن یا اگزالونیتریل (CN) 2 نیز به عنوان یک ماده شیمیایی واسطه ای و بخاری استفاده می شود.
آزیدها ، که ممکن است معدنی یا آلی باشند ، ترکیباتی هستند که شامل سه اتم نیتروژن به عنوان یک گروه هستند که به صورت (―N3) نشان داده شده اند. بیشتر آزیدها در برابر شوک ناپایدار بوده و بسیار حساس هستند. برخی از آنها ، مانند سرب آزید ، سرب (N3) 2 در مواد منفجره و درپوش های کوبه ای استفاده می شوند. آزیدها مانند ترکیبات هالوژن با جابجایی گروه به اصطلاح آزید به آسانی با سایر مواد واکنش می دهند و انواع مختلفی از ترکیبات را تولید می کنند.
نیتروژن هزاران ترکیب آلی تشکیل می دهد. بسیاری از انواع شناخته شده ممکن است از آمونیاک ، سیانید هیدروژن ، سیانوژن و اسید نیتروژن یا نیتریک در نظر گرفته شوند. به عنوان مثال ، آمینها ، آمینو اسیدها و آمیدها از آمونیاک ناشی می شوند. نیتروگلیسیرین و نیتروسلولوز استرهای اسید نیتریک هستند. ترکیبات نیترو از واکنش (به نام نیتراسیون) بین اسید نیتریک و یک ترکیب آلی حاصل می شود. نیتریت ها از اسید نیتروژن (HNO2) گرفته می شوند. ترکیبات نیتروسو با عملکرد اسید نیتروژن بر روی یک ترکیب آلی به دست می آید. پورین ها و آلکالوئیدها ترکیبات هتروسیکلی هستند که در آنها نیتروژن جایگزین یک یا چند اتم کربن می شود.
خواص و واکنش
نیتروژن گازی بی رنگ و بی بو است که در دمای 951 درجه سانتیگراد به یک مایع بی رنگ و متحرک متراکم می شود. این عنصر به عنوان مولکول های N2 وجود دارد ، مانند: N ::: N: ، که برای آن انرژی پیوند 226 کیلو کالری در هر مول تنها با مونوکسید کربن ، 256 کیلو کالری در هر مول فراتر می رود. به دلیل همین انرژی پیوند بالا ، انرژی فعال سازی برای واکنش نیتروژن مولکولی معمولاً بسیار زیاد است و باعث می شود نیتروژن در اکثر معرفها در شرایط عادی نسبتاً بی اثر باشد. علاوه بر این ، پایداری بالای مولکول نیتروژن به بی ثباتی ترمودینامیکی بسیاری از ترکیبات نیتروژن کمک می کند ، که در آن اوراق قرضه اگرچه از نظر منطقی قوی است ، اما به مراتب کمتر از آنهایی که در ازت مولکولی هستند. به همین دلایل ، به نظر می رسد نیتروژن عناصر کاملاً مؤثر ماهیت واکنش پذیری اتمهای فردی آن را پنهان می کند.
یک کشف نسبتاً جدید و غیر منتظره این است که مولکولهای نیتروژن قادر به عنوان لیگاند در ترکیبات مختلط هستند. مشاهده اینکه برخی محلولهای مجتمع روتنیوم می توانند نیتروژن اتمسفر را جذب کنند ، باعث شده است که امیدوارم روزی روشی ساده تر و بهتر از اصلاح نیتروژن پیدا شود.
یک شکل فعال ازت ، احتمالاً حاوی اتم های نیتروژن آزاد ، با عبور گاز ازت با فشار کم از طریق تخلیه الکتریکی با فشار بالا می تواند ایجاد شود. این محصول با نور زرد درخشان است و بسیار واکنش پذیرتر از نیتروژن مولکولی معمولی است و با هیدروژن اتمی و گوگرد ، فسفر و فلزات مختلف ترکیب می شود و توانایی تجزیه اکسید نیتریک ، NO و N2 و O2 را دارد.
یک اتم نیتروژن دارای ساختار الکترونیکی است که توسط 1s22s22p3 نشان داده شده است. پنج الکترون پوسته بیرونی بار هسته ای را بسیار ضعیف نشان می دهند ، با این نتیجه که بار هسته ای مؤثر که در فاصله شعاع کووالانسی احساس می شود نسبتاً زیاد است. بنابراین اتمهای نیتروژن از نظر اندازه نسبتاً كوچك و از نظر میزان انرژی زیاد هستند و بین كربن و اکسیژن در هر دو این خاصیت واسطه هستند. پیکربندی الکترونیکی شامل سه مداری بیرونی نیمه پر است که به اتم توانایی تشکیل سه پیوند کووالانسی را می دهند. بنابراین ، اتم نیتروژن باید یک گونه بسیار واکنش پذیر باشد و با اکثر عناصر دیگر ترکیب شود تا ترکیبات باینری پایدار ایجاد شود ، به ویژه هنگامی که عنصر دیگر در الکتروونگاتیویته به اندازه کافی متفاوت باشد تا قطبیت قابل توجهی به اوراق قرضه منتقل شود. هنگامی که عنصر دیگر از قدرت نیتروژن نسبت به نیتروژن پایین تر باشد ، قطبیت بار منفی جزئی به اتم نیتروژن می دهد و باعث می شود تا الکترون های جفت تنها برای هماهنگی در دسترس باشند. با این حال ، هنگامی که عنصر دیگر الکترو مغذی تر است ، با این وجود بار مثبت جزئی ناشی از نیتروژن تا حد زیادی خاصیت اهدا کننده مولکول را محدود می کند. هنگامی که قطبیت باند کم است (به دلیل الکترونگا بودن عنصر دیگر که شبیه به نیتروژن است) ، پیوندهای متعدد به شدت نسبت به پیوندهای منفرد طرفدار هستند. اگر اختلاف اندازه اتمی از چنین پیوندهای متعدد جلوگیری کند ، احتمالاً پیوند منفردی که تشکیل می شود نسبتاً ضعیف است و احتمالاً این ترکیب با توجه به عناصر آزاد ناپایدار باشد. تمام این خصوصیات پیوند نیتروژن در شیمی عمومی آن قابل مشاهده است
شیمی تجزیه
اغلب درصد نیتروژن موجود در مخلوط های گازی با اندازه گیری حجم پس از جذب سایر اجزای دیگر توسط مواد شیمیایی قابل تعیین است. تجزیه نیترات توسط اسید سولفوریک در حضور جیوه ، اکسید نیتریک را آزاد می کند ، که می تواند به عنوان یک گاز اندازه گیری شود. نیتروژن هنگامی که بر روی اکسید مس سوزانده شود از ترکیبات آلی رها می شود و پس از جذب سایر محصولات احتراق ، نیتروژن آزاد می تواند به عنوان گاز اندازه گیری شود. روش معروف Kjeldahl برای تعیین مقدار نیتروژن ترکیبات آلی شامل هضم ترکیبات با اسید سولفوریک غلیظ (اختیاری حاوی جیوه ، یا اکسید آن و نمکهای مختلف ، بسته به ماهیت ترکیب نیتروژن است). به این ترتیب ، نیتروژن موجود به سولفات آمونیوم تبدیل می شود. علاوه بر این مقدار اضافی هیدروکسید سدیم آمونیاک آزاد را آزاد می کند ، که در اسید استاندارد جمع آوری می شود. مقدار اسید باقیمانده ، که با آمونیاک واکنش نشان نداده است ، با تیتراسیون تعیین می شود.
اهمیت بیولوژیکی و فیزیولوژیکی
همانطور که ممکن است با توجه به اهمیت حضور نیتروژن در ماده زنده ،که بیشتر ترکیبات نیتروژن آلی از نظر فیزیولوژیکی فعال هستند. بیشتر موجودات زنده نمی توانند از نیتروژن به طور مستقیم استفاده کنند و باید به ترکیبات آن دسترسی داشته باشند. بنابراین تثبیت نیتروژن از اهمیت حیاتی برخوردار است. در طبیعت ، دو فرآیند اصلی تثبیت نیتروژن شناخته شده است. یکی عمل انرژی الکتریکی بر اتمسفر است که مولکول های نیتروژن و اکسیژن را از هم جدا می کند و به اتم های آزاد اجازه می دهد تا اکسید نیتریک ، NO و دی اکسید نیتروژن ، NO2 تشکیل دهند. دی اکسید نیتروژن سپس با آب واکنش نشان می دهد.
به شرح زیر است:
اسید نیتریک ، HNO3 ، به عنوان یک محلول بسیار رقیق ، محلول می شود و همراه با باران به زمین می آید. با گذشت زمان ، بخشی از نیتروژن ترکیبی خاک است ، جایی که خنثی می شود ، تبدیل به نیترات و نیترات می شود. میزان نیتروژن خاک زیر کشت شده توسط کودهای حاوی نیترات و نمک آمونیوم به طور مصنوعی غنی و تجدید می شود. دفع و پوسیدگی حیوانات و گیاهان ترکیبات نیتروژن را به خاک و هوا باز می گرداند و برخی باکتری های موجود در خاک ترکیبات نیتروژن را تجزیه می کنند و عنصر را به هوا باز می گردانند.
فرآیند اصلی اصلاح نیتروژن طبیعی برخی از گیاهان و سبزیجات به نام حبوبات است. از طریق یک عمل همکاری با باکتری ها ، حبوبات قادر به تبدیل نیتروژن جوی به طور مستقیم به ترکیبات نیتروژن هستند. برخی از باکتری ها به تنهایی مانند Azotobacter chroococcum و Clostridium pasteurianum نیز قادر به رفع نیتروژن هستند.
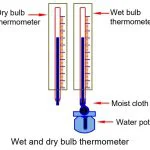
نیتروژن به خودی خود بی اثر است ، بجز وقتی که تحت فشار تنفس می شود ، معصوم است و در این حالت بیشتر از غلظت طبیعی در خون و سایر مایعات بدن حل می شود. این به خودی خود اثر مخدر ایجاد می کند ، اما اگر فشار خیلی سریع کاهش یابد ، نیتروژن اضافی به عنوان حباب گاز در مکان های مختلف بدن تکامل می یابد. اینها می تواند باعث درد عضلات و مفاصل ، غش ، ضعف جزئی و حتی مرگ شود. به این علائم “خم شدن” یا بیماری رفع فشار گفته می شود. غواصان ، هوانوردیها ، کسانی که در کیسونهای عمیق کار می کنند که فشار هوا خیلی سریع کاهش یافته است ، و دیگران که مجبور به تنفس هوا هستند تحت فشار هستند بنابراین باید بسیار مراقب باشند که به دنبال قرار گرفتن در معرض ، فشار بسیار آهسته کاهش یابد. این باعث می شود نیتروژن اضافی بدون ایجاد حباب از طریق ریه ها بی ضرر رها شود. جایگزین بهتر جایگزین کردن ترکیبات اکسیژن و هلیوم برای هوا است. هلیوم در مایعات بدن بسیار کمتر محلول است و از این رو خطرات کاهش می یابد.
ایزوتوپ های ازت
نیتروژن به عنوان دو ایزوتوپ پایدار ، 14N (فراوانی 99.63 درصد) و 15N (فراوانی 37/0 درصد) وجود دارد. اینها را می توان با تبادل شیمیایی یا انتشار حرارتی جدا کرد. ایزوتوپهای رادیواکتیو مصنوعی دارای توده های 10-13 و 24-24 هستند. پایدارترین آنها نیمه عمر تنها در حدود 10 دقیقه است. اولین انتقال هسته ای ناشی از مصنوعی توسط فیزیکدان انگلیسی ، ارنست رادرفورد ، که نیتروژن 14 را با ذرات آلفا بمباران می کند تا هسته های اکسیژن 17 و پروتون ها را بمباران کند ، گزارش شد (1919).